미생물학실험 레포트 (1): Gram staining & Catalase test
1.1 Abstract
본 실험은 배양된 균을 이용하여 Gram staining과 Catalase test를 하여 균이 Gram 양성균인지 음성균인지 확인하고 호기성인기 혐기성인지 관찰하는 실험이다. Gram staining은 Gram 양성균과 음성균의 peptidoglycan 층의 두께 차이로 인해 각각 다른 색으로 염색된다. Gram staining은 slide glass에 균을 도말하고 고정 후에 Crystal violet, Iodine, 95% ethanol, Safranin O 시약 처리를 하여 현미경으로 관찰한다. 그 결과 Escherichia coli는 붉은색의 bacillus 형태로 발견되었고 Pediococcus acidilactici는 보라색의 coccus 형태로 발견되었다. Catalase test는 3% 과산화수소 처리하였을 때 기포발생의 유무를 관찰한다. E. coli는 기포가 발생하였고 P. acidilactici는 기포가 발생하지 않았다. 실험결과, E. coli는 gram-negative로서 Catalase positive균이며 P. acidilactici는 gram-positive로서 Catalase negative균임을 확인할 수 있었다. E. coli 가 P. acidilactici보다 호기성이라고 추정한다. 추가 실험을 더 한다면 균의 혐기성과 호기성을 판단 할 수 있을 것이라 생각한다.
2. Introduction
2.1 Gram 양성균과 음성균의 차이(peptidoglycan층)
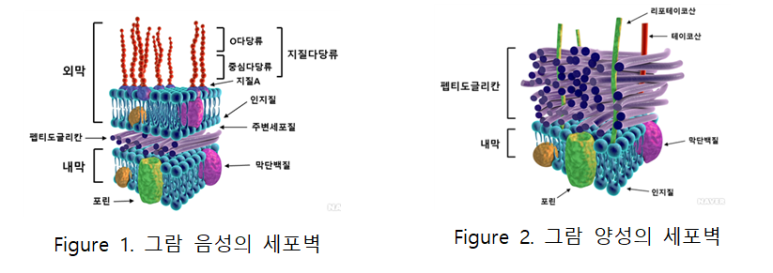
세균은 크게 그람양성균과 그람음성균으로 분류된다. 그람 음성균은 원핵세포의 한 종류로서 세포벽이 그람양성균에 비해 상대적으로 적은 양의 펩티도글리칸을 갖는 대신 지질다당질, 지질단백질, 및 다른 복잡한 고분자물질로 구성된 외막을 갖는다. 크리스탈 바이올렛과 같은 염기성 염료로 염색한 후 에탄올을 처리하면 탈색이 일어나고 사프라닌과 같이 붉은색의 염료로 대비 염색을 하면 붉은색으로 관찰된다.
그람음성균의 세포벽은 그람양성균에 비해 매우 얇은 펩티도글리칸과 외막으로 구성되어있다. 펩티도글리칸은 외막과 연결되어 있는 지질단백질과 결합하고 있으며 테이코산은 포함하지 않는다. 그람음성균의 외막과 내막 사이에는 약 15 nm 두께의 공간인 세포주변질(periplasm)이 존재하며 높은 농도의 단백질을 포함하여 세포질과 유사한 상태를 유지한다. 그람음성균의 세포 외막은 지질다당류(LPS, lipopolysaccharides), 지질단백질(lipoproteins), 그리고 인산으로 구성되어있다. LPS의 지질 부분인 지질A은 내독소(endotoxin)로 작용하며 세균이 파괴되거나 유리된 상태에서도 독성을 유지할 수 있다. 또한 세포 외막에는 포린이라는 단백질이 세포막 내부와 외부로 수용성 물질을 이동하는 역할을 한다.
그람양성균은 원핵생물의 한 종류로서 그람염색법에 의해 세포벽이 보라색으로 염색되는 세균을 총칭한다. 그람양성균의 세포벽은 여러겹의 펩티도글리칸으로 구성되어 있어 형성된 두껍고 단단한 세포벽을 가진다. 크리스탈 바이올렛과 같은 염기성 염료로 염색한 후 에탄올을 처리해도 탈색되지 않고 보라색으로 나타난다.
그람 양성균의 세포벽에는 테이코산이라는 산성물질들이 포함되어 있다. 테이코산은 글리세롤 또는 리비톨과 같은 알코올과 인산으로 구성되어있다. 테이코산의 인산기는 음전하를 띠기 때문에 세포 표면의 음전하에 영향을 미친다. 따라서 2가 양이온이 세포벽 표면에 결합하는데 영향을 미친다. 그람양성균을 분류하기 위해 실험실에서는 세포벽을 구성하는 테이코산을 항원으로 인식하는 항체들을 이용해 그람 양성균을 확인하는데 이용될 수 있다.
펩티도글리칸 층은 그람양성균에서 총 건조 중량의 90%를 차지하지만 그람음성균에서는 10% 남짓 차지한다. 그람양성균, 그람음성균 모두에서 2nm 이하의 입자는 펩티도글리칸을 통과할 수 있다. 매우 얇은 층이지만, 25 기압 정도까지의 팽압을 견디게 할만큼 충분한 강성을 지녔지만, 다공성 3차원 구조를 지녔기 때문에 물질의 확산이 자유롭다. 따라서 펩티도글리칸의 물리적 성질은 세균의 생존에 필수적이다.
열로 고정화된 표본을 크리스탈 바이올렛으로 염색하고 요오드 용액을 처리하여 에탄올로 세척하면 펩티도글리칸과 같은 다당류는 탈색되지 않아 자주색으로 보인다. 에탄올을 처리했을 때 탈색된 균은 사프라닌으로 반대염색을 통해 핑크빛으로 염색된다. 같은 과정을 반복했을 때 펩티도글리칸과 같은 다당류는 탈색되지 않아 보라색으로 보인다. 에탄올을 처리했을 때 탈색된 균은 사프라닌으로 반대염색을 통해 핑크색으로 염색된다. 그람 양성균과 음성균은 세포벽의 구조적 차이에 의해 각각 다른 색으로 염색되어 분류된다.
2.2 Oxygen and microbial growth(aerobes, anaerobes, facultative aerobes or anaerobes, aerotolerant anaerobes, microaerophiles)
통성혐기성 혹은 조건부혐기성 생물은 산소가 있는 조건에서 산소를 최종전자수용체로 사용하여 호흡을 하지만, 산소가 없는 조건에서도 무산소 호흡 혹은 발효(fermentation)을 통해 살아갈 수 있는 생명체를 의미한다. 박테리아와 같은 미생물들은 종류에 따라 산소에 대한 요구도와 내성이 서로 다르다. 산소를 최종전자수용체로 사용하는 세포호흡을 할 수 있는 생명체를 호기성 생물(aerobe)라고 하며, 산소를 이용하는 세포호흡을 할 수 없는 생명체를 혐기성 생물(anaerobe)이라고 한다. 절대호기성 생물 (obligate aerobe, strict aerobe)은 세포호흡 시에 전자전달계의 최종전자수용체로 산소만을 사용하는 생물로서 호흡을 위해 산소를 절대적으로 필요로 하는 생물이다. 절대호기성 생물은 대기의 산소분압(~20%)에서 잘 자라며 더 높은 산소분압도 견딜 수 있다. 미호기성 생물(microaerophile) 은 산소호흡을 하지만 일반적인 대기의 산소분압(~20%)에서는 자라지 못하고 2~10%의 산소분압에서 성장을 하는 생물이다. 통성혐기성 생물(facultative aerobe)은 산소가 있을 경우에는 산소를 최종전자수용체로 사용하는 세포호흡을 한다. 하지만, 산소가 없을 경우에도 산소 이외의 다른 물질을 최종전자수용체로 사용하는 무산소호흡(anaerobic respiration)이나 전자전달계를 이용하지 않는 발효(fermentation)를 통해 에너지를 얻으며 살아갈 수 있다. 절대 혐기성 생물(strict anaerobe, obligate anaerobe)은 산소를 이용하는 세포호흡을 할 수 없으며, 산소가 존재하면 살 수 없는 생물이다. 절대 혐기성 생물은 산소호흡 대신 발효나 무산소호흡을 통해 에너지를 얻는다. 무산소 호흡에서는 전자전달계의 최종전자수용체로 산소 대신 다양한 종류의 염 (SO42-, NO3- 등), 산화된 금속이온(철, 망간, 수은 등), 혹은 일산화탄소 등을 사용된다. 젖산 발효, 알코올 발효 등 다양한 종류의 발효를 통해서도 산소에 의존하지 않고 에너지를 얻을 수 있다. 발효와 무산소 호흡 모두 산소를 이용하지 않지만, 발효는 무산소호흡과 달리 전자전달계를 거치지 않기 때문에 산화적인산화(oxidative phosphorylation)에 의한 ATP가 생성되지 않는다는 차이가 있다. 내기성 혐기성 생물(aerotolerant anaerobe)은 산소를 최종전자수용체로 사용하는 세포호흡을 할 수 없는 혐기성 생물이지만, 산소의 독성에 저항하는 능력을 가지고 있어 산소가 있는 조건에서도 죽지 않고 살아갈 수 있는 생물이다.
2.3 Cell morphology에 대해(Introduction에 자세히 서술)

Cell Morphology의 형태에는 구균(Cocci)과 간균(Bacilli), 그리고 그 외(Others)로 형태학적으로 구분된다. Cocci와 Bacilli 등 Cell은 세부적인 형태에 따라 더욱 세분화된다. 특정 모양은 박테리아 적합성을 최적화하는 적응 압력의 결과이다. 모양은 영양소 획득, 운동성, 분산, 스트레스 저항 및 다른 유기체와의 상호 작용을 포함한 중요한 생물학적 기능에 영향을 미치고, 세균의 형태는 궁극적으로 펩티도글리칸 (PG) sacculus에 의해 결정된다.
본 실험에서 사용된 균인 E. coli의 경우 bacillus의 형태를 보였으며 P. acidilactici의 경우에는 coccus의 형태를 보였다.
3. Materials & Methods
3.1 Materials
Gram staining와 Catalase test 실험에서는 균주 Pediococcus acidilactici가 자란 MRS 배지, 균주 Escherichia coli가 자란 LB 배지, slide glass, cover glass, immersion oil, 광학현미경, 백금이, 알코올램프, 증류수, Crystal violet 염색약, Iodine 시약, 95% ethanol, Safranin O 시약, hollow glass, 3% 과산화수소수가 필요하다.
3.2 Methods
Gram staining을 하기 위해 화염멸균한 백금이을 이용하여 P. acidilactici와 E. coli의 colony를 취한 뒤 slide glass에 도말하고다시 화염 멸균한다. 증류수를 백금이에 한 방을 떨어뜨린 후 백금이를 이용하여 smearing한다. 그리고 알코올램프 위에서 살짝 건조시켜 화염 고정시킨다. 이후 Crystal violet 염색약을 1방을 떨어뜨린 뒤 60초간 염색하고 slide glass 뒷면에 흐르는 물로 수세한다. 이후 Iodine 시약을 1방을 떨어뜨리고 60초가 지나면 수세한다. 그리고 95% ethanol을 1방울 떨어뜨린 뒤 20초간 기다리고 수세한다. 마지막으로 Safranin O 시약을 1방울 떨어뜨린 뒤 45초 후에 수세한다. 이후 주위의 물기를 잘 제거한 뒤에 cover glass를 올리고 immersion oil을 이용하여 1000배율의 광학현미경을 이용하여 검경한다.
Catalase test를 하기 위해서는 백금이를 이용하여 colony를 취한 뒤에 hollow glass에 각 균들을 도말한다. 이후 3%의 과산화수소수를 1~2방울 떨어뜨려 기포 발생 여부를 확인한다.
4. Results & Discussion

Gram staining 실험결과 Figure 4에서와 같이 P. acidilactici 의 그람염색 결과 보라색 구형 균으로 그람 양성인 것을 알 수 있다. 균이 고르게 분포되어있지 않고 뭉쳐있는 것을 알 수 있었다. 실험시 도말을 더 많이 했다면 균일한 분포의 균을 관찰 할 수 있었을 것이다. Pediococcus acidilactici는 보통 쌍 또는 4개로 흔히 발견되는 그람 양성 구균의 종이다. 실험결과 사진에서도 뭉쳐져 있는 부분을 제외한 영역에서 쌍 형태인 P. acidilactici의 모습을 확인 할 수 있었다. Figure 4은 직접 실험한 결과가 아니고 조원의 실험 결과이다. 본인의 실험결과에서는 P. acidilactici 의 모습을 찾을 수 없었다. 이유는 균을 염색하는 과정 중 수세 과정에 도말한 방향으로 수세를 진행해 균이 씻겨나갔다고 생각한다. 슬라이드 글라스에 방향을 라벨링하거나 방향에 주의하며 수세하거나 클램프를 사용한다면 방향 실수하지 않을 것이다. Figure 5 실험결과 사진을 보면 염색결과 분홍색 간균의 모습으로 그람 양성의 E. coli을 확인할 수 있다. P. acidilactici 와 비교해 도말이 더 잘되어 보다 균일하게 분포해있는 것을 알 수 있다. 사진을 확대해 보면 이어져 있는 모습의 균을 확인 할 수 있다. 이는 분열 중인 세포일 것으로 추정한다. 또한, P. acidilactici은 비교적 균일한 크기의 구형 형태인 것을 알 수 있고, E. coli는 다양한 길이의 막대 모양의 균인 것을 알 수 있었다. 이는 균을 취할 때 하나의 콜로니에서 취하지 않고 2~3개의 콜로니를 취해 도말했기 때문이라고 추정한다. 이 실험을 통해서 Gram staining을 통해 보라색으로 염색되고 형태학적인 측면에서 cocci이며 coccus, 특히 쌍의 형태로도 관찰되는 P. acidilactici는 gram-positive임을 알 수 있었고, 붉은색으로 염색되며 형태학적으로 bacilli이며 bacillus 형태를 가지는 E. coli의 경우 gram-negative임을 알 수 있었다.
Catalase test는 E. coli와 P. acidilactici를 Catalase test하여 각 균들이 호기성의 특징을 가지는지 혐기성의 특징을 가지는지 확인하는 실험이다. Figure 3.에서 위의 P. acidilactici가 도말된 hallow glass는 기포가 발생하지 않는 모습을 보여 catalase negative이고 , 아래의 E. coli가 도말된 hallow glass는 기포가 발생하고 있는 모습으로 catalase positive인것을 확인할 수 있다. E. coli 가 P. acidilactici보다 호기성이라고 추정한다. 하지만 P. acidilactici와 E. coli 모두 통상혐기성 생물이다. catalase test 하나만으로는 세포의 호기성, 혐기성을 판단할 수 없다.
[논문] E. coli는 과산화 수소를 물과 산소로 분해하는 catalase 효소 2가지(hydroperoxidase I (HPI) and HPII)를 가지고 있다. 대부분의 통성 및 호기성 유기체에는 superoxide dismutase라고하는 효소가 고농도로 포함되어 있다. 이 효소는 superoxide 음이온을 기저 상태의 산소와 과산화수소로 전환하여 세포에서 파괴적인 슈퍼 옥사이드 음이온을 제거한다. 이 반응에서 생성된 과산화수소는 산화제이지만 superoxide 음이온만큼 세포를 손상시키지 않으며 세포밖으로 확산되는 경향이 있다. 많은 유기체는 과산화수소를 제거하기 위해 catalase 또는 peroxidase또는 둘 다 보유한다. Catalase는 산화제 (전자 수용체)와 환원제 (전자 공여체)로 H₂O₂를 사용하여 과산화물을 물과 기저 상태 산소로 변환한다. Peroxidase는 H₂O₂ 이외의 환원제를 사용한다. (H₂O₂ + H₂R ---> 2H₂O + R)
한 연구에 따르면 superoxide dismutase가 부족한 통성 및 호기성 유기체는 높은 수준의 catalase 또는 peroxidase를 보유하고 있다. 이러한 효소의 농도가 높으면 superoxide dismutase의 필요성이 완화될 수 있다. superoxide 음이온과 반응하여 더 활성적인 하이드록실 라디칼을 형성하기 전에 H₂O₂를 효과적으로 제거하기 때문이다. 그러나 대부분의 유기체는 superoxide dismutase의 활성과 산소의 독성에 대한 내성 사이에 양의 비례적인 상관관계를 보인다. 박테리아 사이의 지속적인 산소 내성 스펙트럼은 부분적으로는 세포에서 superoxide dismutase, catalase, peroxidase의 활동과 부분적으로는 세포가 산소를 흡수하는 속도 때문인 것으로 보인다. 그밖에도 다른 요인은 내성에 영향을 미치는데, 세포 내 보호 효소의 위치 (표면 대 세포질), 세포가 독성 산소 생성물 (예 : 하이드록실 라디칼 또는 일중항 산소)을 형성하는 속도, 독성 산소에 대한 주요 세포 구조의 민감도 등에 영향을 받는다. 따라서 catalase test와 함께 superoxide dismutase test, peroxidase test를 진행한다면보다 정밀한 실험결과를 얻을 수 있을 것이다.

위의 두 실험을 통해서 P. acidilactici는 gram-positive 균으로, catalase 음성이지만 통성혐기성으로 superoxide dismutase, peroxidase를 산소 독성을 견딜 만큼 충분히 가지고 있을 것이라고 추정된다. E. coli는 gram-negative 균으로 catalase 양성이며 aerobes의 특징을 가지는 것을 확인할 수 있었다. E. coli 또한 superoxide dismutase, peroxidase anaerobes는 양성일 것이라고 추정한다.
[논문] 한 논문에서는 Sphingomonas 속 균들의 생리적 특성을 확인하기 위해서 Catalase 실험뿐만 아니라 oxidase 활성에 대해서도 확인한 경우도 있었다. Catalase 활성은 위 실험과 마찬가지로 3% hydrogen peroxide를 떨어뜨려 기포 생성 유무를 관찰하여 기포가 생기면 양성으로 판단하였다. Oxidase 활성의 경우 R2A agar에서 배양한 균의 소량을 멸균한 면봉 끝에 묻힌 후 oxidase reagent (bioMérieux)를 떨어뜨려 10~30초 사이에 보라색을 띄면 양성, 30초 이후 보라색을 띠거나 색이 변하지 않을 때 음성으로 판단하며 균의 생리적 특성을 확인하였다. 균의 생리적 특징을 확인하는 방법에는 catalase test뿐만 아니라 oxidase 활성 실험도 활용되고 있음을 확인할 수 있었다. 또한, Gram reaction을 통해서 그람 음성 세균과 그람 양성 세균으로 해석하는 방법을 사용하였는데, 유리 슬라이드 글라스에 2-3 개의 colony를 묻힌 후, 한 방울의 3 % KOH를 떨어뜨린 다음 2mm 직경의 루프로 섞어주면서 string 현상을 관찰한다. 60초 사이에 string 현상이 일어나면 양성이며 그람 음성 세균, string 현상이 일어나지 않으면 음성이며 그람 양성 세균으로 해석하기도 하였다.
5. Homework
5.1 Gram 양성균과 음성균의 차이
Introduction에 서술했다.
5.2 Gram staining의 원리와 방법(각 시약의 용도를 자세하게 서술)
세균 시료에 crystal violet을 더하고 1분동안 염색하고 요오드 용액으로 염색이 더 잘 되도록 한다(이 과정을 착색이라고 한다). 알코올로 가볍게 세척하고(이 과정을 탈색이라고 한다) 대비염색(counter-stain)으로 빨간색인 safranin으로 염색한 후에 관찰한다. Crystal violet의 짙은 파란색으로 염색된 세균을 그람 양성(Gram-positive: Gram +로 표기) 세균, 탈색된 후 빨간색으로 염색된 세균을 그람 음성(Gram −) 세균이라고 부른다.
또한 Gram staining에서 Crystal Violet은 본염색을 위해 사용하는데 펩티도글라이칸 층에 염색약이 결합한다. 그람 양성의 펩티도글리칸 층이 많으므로 많이 염색약과 결합이 많다. Iodine은 염색이 잘 되도록 하는 매염제 역할을 위한 용도이며 염색제와 세포벽의 결합을 단단하게 한다. 95% ethanol은 본염색에 의해 보라색으로 염색된 균들의 탈색, 지질을 녹여 탈색된다. 그리고 Safranin O 시약은 탈색된 균들을 빨간색과 같은 대조염색을 위해 사용된다. 염색약이 탈색된 자리에 결합한다.
그람 염색결과의 차이에 따라 그람 양성세균과 그람 음성세균의 세포벽 구성이 크게 다르고, 이에 따라 이들의 주요 서식지와 중요한 생리학∙생화학적 대사에도 차이를 보인다. 그람 양성 세균은 세균 세포벽의 주성분인 펩티도글리칸(peptidoglycan) 층이 200~300층으로 매우 두꺼운 반면 그람 음성 세균의 세포벽은 5층 이하의 얇은 펩티도글리칸 층 외부에 외막(outer membrane)을 가지고 있다. 한편 외막의 외부구조는 당과 지질이 결합된 지질다당류(lipopolysaccharides, LPS)로 구성되었는데 이 성분은 그람 음성 세균들마다 다르며, 이 성분이 사람의 몸에 일정량 이상 침투되면 설사와 구토 등의 증상을 보인다. 이처럼 그람 염색의 차이에 따라 중요한 차이를 보이기 때문에 지금도 주변환경에 세균을 분리하고 연구할 때 그람 염색을 시도하여 그람 양성과 음성의 판별을 1차로 수행한다.
5.3 Oxygen and microbial growth(aerobes, anaerobes, facultative aerobes or anaerobes, aerotolerant anaerobes, microaerophiles)
Introduction에 서술했다.
5.4 Catalase test의 원리 및 반응식, test방법
산소를 사용하는 대부분의 호기성 또는 통성 혐기성 균들은 산소를 최종 전자 수용체로 이용하여 물로 변환시키는 과정에서 세균 자체에 유해한 과산화수소(H2O2)를 생산한다. 과산화수소는 매우 반응성이 높아 세포에 독성을 나타낸다.
이러한 독성이 강한 과산화수소는 균이 합성해내는 카타라제에 의해 독성이 없는 물과 산소로 변환되기 때문에 균은 생존이 가능하다. 카타라제는 시토크롬을 갖는 호기성 또는 대부분의 통성 혐기성 세균에 존재하나 내기성 세균에서는 생산되지 않는다. 따라서 통성 혐기성 세균이나 호기성 세균에 과산화수소를 가하면 즉시 카타라제에 의해 물과 산소로 변환되므로 이때 산소 방울 즉 기포발생을 관찰할 수 있게 된다.
반응식은 다음과 같다.
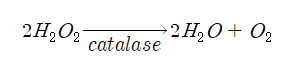
백금이를 이용하여 colony를 1백금이 취한 뒤 hollow glass에 도말해준다. 그 후 3% 과산화수소를 1~2방울 떨어뜨려 기포발생을 확인한다. 이 때 기포가 발생하는 것이 catalase를 가지고 있는 호기성균이고 기포가 발생하지 않는 것이 catalase를 가지지 않은 혐기성균이다.
5.5 현미경의 각 부분의 명칭과 기능 (+Bacteria 관찰 시 1000배 관찰 이유?)
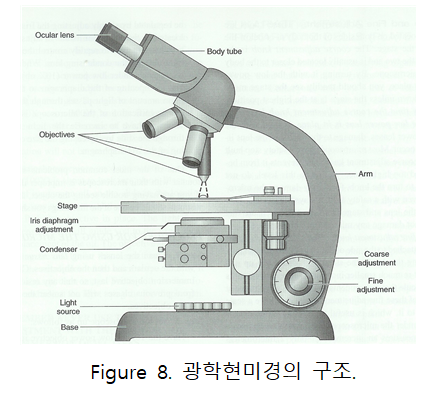
광학현미경은 현미경 경통의 상단에 있는 렌즈로 대물렌즈가 확대한 상을 더욱 확대시키는 역할을 하는 접안렌즈, 현미경 경통의 하단에 있는 대물렌즈 회전판에 붙어있는 대물렌즈, 광원의 세기를 조절할 수 있는 장치와 빛의 양을 조절할 수 있는 조리개, 광원에서 오는 빛을 일정한 방향으로 모아서 대물렌즈에 보내는 역할을 하며 해상도를 높이고 밝은 시야를 얻기 위해 필요한 집광기가 있다. 또한 가장 아래에서 현미경 전체를 지탱하는 경각, 산단 경통에 부착된 경주가 있으며 경각과 경주는 현미경을 운반할 때 사용한다. 또한 현미경의 초점을 대략적으로 맞출 때 사용하는 조동나사와 초점을 정확하게 맞출 때 사용하는 미동나사가 있으며 슬라이드 글라스를 올려놓는 재물대, 슬라이드 글라스를 정확하고 원활하게 이동시킬 수 있는 상하, 좌우 조절나사가 있다.
Bacteria 관찰 시 1000배로 관찰하는 이유는, 박테리아의 크기는 0.5–5.0 마이크로 미터이다. 광학현미경은 상을 약 1000배 확대함으로써 원핵세포의 크기, 모양 및 운동을 비교적 쉽게 관찰할 수 있게 하기 때문에 1000배 확대하여 관찰한다.
5.6 현미경 사용 시 Immersion oil 사용 이유
Slide glass를 통과한 빛은 공기를 통과하여 대물렌즈에 도달한다. 이때 immersion oil을 사용하면 빛이 공기가 아닌 oil을 통과한다. 대물렌즈와 피검체 사이를 굴절률이 높은 매질인 기름으로 채워 개구수를 크게 하여 분해능을 향상시키는 방법이다. Oil의 굴절률이 유리와 같아서 빛의 산란이 거의 없이 대물렌즈에 도달하게 되고 따라서 상이 선명해진다. 따라서 현미경 사용 시 immersion oil을 사용한다. 오래 전에는 세다기름을 사용하였지만 현재는 방치해도 굳어지지 않는 전용 기름을 개발하여 사용하고 있다. 현미경 깔유리, 유침용 기름, 대물렌즈의 선구슬의 굴절률이 같아지므로 균등액침이라고도 한다. 오일, HI 또는 검은 머리띠모양 조각으로 표시한다.
5.7 Cell morphology에 대해
Introduction에 서술했다.
5.8 Surrogate 균이란?
유해한 균의 경우 실험을 함에 있어서 감염 등의 문제가 발생할 수 있기 때문에 대신에 ‘무해한’ 종류의 대리 균을 사용하기도 하는데 이를 surrogate 균이라고 한다.
비병원성 Surrogate 박테리아는 안전 및 위생 문제로 인해 Listeria monocytogenes, Salmonella, Escherichia coli O157 : H7 및 Clostridium botulinum과 같은 식인성 병원균 대신 다양한 식품 연구에 널리 사용한다. Surrogate 박테리아는 연구에서 주어진 조건하에서 표적 병원체와 유사한 성장 특성 또는 비활성화 역학을 가져야 한다. 미생물 비활성화 과정을 검증할 때 잠재적인 Surrogate 박테리아를 신중하게 선택하고 검증하는 것이 매우 중요하다. 검증된 Surrogate는 적절한 통계 분석과 일치하여 주어진 조건하에서 비활성화 역학, 성장 매개 변수 또는 생존 가능성에 대해 테스트할 때 표적 병원체와 유사하게 반응한다. 현장 연구의 경우, Surrogate 균주 개발을 위한 Surrogate 균주 또는 부모 균주는 일반적으로 표적 병원균의 자연 또는 인위적으로 약 독화 된 균주, 유전적으로 가까운 비병원성 종의 균주 및 유전적으로 먼 비병원성 종의 균주의 세 가지 범주로 분류된다. 표적 병원체의 약독화 된 균주는 병원체의 특성을 가장 근접하게 모방하나, 유전적으로 가까운 균주는 표적 병원체와 유사한 생물학적 특성을 가질 가능성이 있다. 이 균주는 병원균에서 유래하지 않기 때문에 더 안전하고 승인을 받을 가능성이 더 높다. 이러한 이유로 병원체의 많은 유전적 친척이 Surrogate로 사용된다. 유전적으로 먼 비병원성 대리 물은 안전성 프로필과 사용 및 생산의 용이성 때문에 선택된다. 표적 병원체와 유전적으로 거리가 멀기 때문에 생물학적 특성이 다를 수 있다. 그러나 연구의 목적에 따라 표적 병원체와 대리의 다른 특성을 고려할 필요가 있다. 예를 들어, 포자의 크기로 B. atrophaeus와 B. subtilis로부터 실질적으로 상이한 B. anthracis, 그들은 공기 역학 Surrogate로 적합하지 않습니다. 그러나 화학 소독제에 대한 민감도는 B. anthracis 와 유사하여 오염 제거 연구에서 Surrogate로 사용할 수 있다.
6. Reference
- [네이버 지식백과] 그람음성균 [Gram-negative bacteria] (미생물학백과)(2021.03.23. 20:00)
https://terms.naver.com/entry.naver?docId=5144703&cid=61232&categoryId=61232
- [네이버 지식백과] 펩티도글리칸 [peptidoglycan] (미생물학백과 ) (2021.03.23. 20:00)
https://terms.naver.com/entry.naver?docId=5144806&cid=61232&categoryId=61232
- [네이버 지식백과] 그람양성균 [Gram-positive bacteria] (미생물학백과 ) (2021.03.23. 20:00)
https://terms.naver.com/entry.naver?docId=5144715&cid=61232&categoryId=61232
- [네이버 지식백과] 그람염색 [gram stain] (미생물학백과) (2021.03.23. 20:00)
https://terms.naver.com/entry.naver?docId=5680257&cid=61232&category
- [네이버 지식백과] 유침 [oil immersion, 油浸] (생명과학대사전, 초판 2008., 개정판 2014., 강영희) (2021.03.23. 20:00)
https://terms.naver.com/entry.naver?docId=420326&cid=60261&categoryId=60261
- [네이버 지식백과] 통성혐기성 생물 [facultative anaerobe] (미생물학백과 ) (2021.03.23. 20:00) https://terms.naver.com/entry.naver?docId=5703131&cid=61232&categoryId=61232
- 강성태 외 1명. 식품미생물학. 2007. 형설출판사, p. 161-162.
- Iwase T, Tajima A, Sugimoto S, et al. A simple assay for measuring catalase activity: a visual approach. https://pubmed.ncbi.nlm.nih.gov/24170119/ (2021.03.23. 20:00)
[논문]
-Sangjin Park,Chang-Hwan Kim,Seong Tae Jeong &Sang Yup. Surrogate strains of human pathogens for field release. 2018. Bioengineered Volume 9, P. 17-24
- 이지희. Sphingomonas 속 세균의 분류학적 연구. 2016. 순천대학교, p. 9-10, 16, 34.